|
Resumen En un vivero localizado en San Isidro, trópico de Cochabamba, se llevó a cabo un estudio que duró 190 días, con el objetivo de evaluar el efecto de la inoculación con micorrizas en el desarrollo de plántulas de tembe para palmito en condiciones de vivero. Los tratamientos estudiados fueron la inoculación con micorrizas y el testigo sin inoculación, en un diseño de bloques completos al azar con cinco repeticiones, empleando un total de 10000 plántulas. La fuente de inóculo de micorrizas fue una mezcla de raíces de kudzú (Pueraria phaseoloides) colonizadas por micorrizas, hifas y esporas, recolectada de una parcela del lugar. Las variables de respuesta fueron altura de planta, número y tamaño de hojas, concentración de macro y micro nutrimentos en el tejido foliar, porcentaje y longitud de raíces colonizadas por micorrizas y peso seco de la biomasa aérea y radicular. Las plántulas colonizadas en comparación con las no inoculadas presentaron, en promedio, incrementos de 113 % en altura, 68 % en longitud de hoja, y 11 % en número de hojas. Asimismo, la biomasa seca de hojas y raíces, fue respectivamente, 211 % y 142 % mayor en las plantas inoculadas. En la biomasa aérea las plantas inoculadas acumularon más macro nutrimentos que las plantas no inoculadas: 296 % más N, 155 % más P, 94 % más K, 77 % más Ca, 131 % más Mg y 60 % más S. Las plantas inoculadas también acumularon más micro nutrimentos que las no inoculadas. Los resultados mostraron que la inoculación de plántulas de tembe en vivero permitió la obtención de plantas más desarrolladas y con mayor acumulación de nutrimentos esenciales en sus tejidos. Introducción En el trópico de Cochabamba (TC) existen más de 3000 ha cultivadas con tembe para palmito (Bactris gasipaes Kunth). En general, los rendimientos de palmito industrializable en la zona indicada son muy bajos comparados con los rendimientos obtenidos en países como Costa Rica y Brasil. Uno de los factores más determinantes de la baja productividad de las plantaciones de tembe para palmito en el área, es la nutrición vegetal deficiente. La utilización de fertilizantes es escasa. Por otra parte, es conocido que esta especie crece muy deficientemente si sus raíces no están asociadas con hongos micorrícicos (Mora-Urpí y Gainza, 1999). La producción de plantas de vivero en el TC no emplea inoculación con micorrizas, por lo que se supone que plantas no micorrizadas son transplantadas en el campo definitivo. En el TC todavía no está claro el grado de colonización por micorrizas nativas que presentan las plantaciones. Probablemente el grado de colonización por micorrizas es bajo en las plantaciones, contribuyendo esto a una baja productividad. La fase de vivero es propicia para inocular con micorrizas a las plantas de tembe, para transplantar plantas ya micorrizadas a la plantación definitiva. La hipótesis fue que plantas de vivero inoculadas con micorrizas son más vigorosas y estarán colonizadas con hifas y vesículas del hongo al momento del transplante. El objetivo del presente trabajo fue evaluar la inoculación con micorrizas en el desarrollo y acumulación de nutrimentos de plantas de tembe para palmito en condiciones de vivero. Materiales y métodos Localización y material vegetal utilizado Se utilizaron plántulas provenientes de un vivero de la Unión de Productores de Palmito (UNAPPAL) localizado en San Isidro, sub alcaldía de Shinahota, TC, que utilizó semillas provenientes de huertos de la zona. Las plantas madre eran predominantemente plantas con espinos de distinta procedencia (Yurimaguas y Costa Rica). Las semillas fueron germinadas en sustrato de aserrín en germinaderos usualmente empleados en viveros de tembe para palmito. Una vez que la plúmula alcanzó 3-4 cm de longitud, las plántulas fueron transplantadas a bolsas (13 cm de ancho * 18 cm de alto (en plano), con perforaciones en su mitad inferior) en un vivero cubierto con malla saram (70 % sombra). Tratamientos y diseño experimental En el experimento se estudiaron dos tratamientos: plántulas con inoculación micorrícica y plántulas no inoculadas. El diseño experimental empleado fue el de bloques completos al azar con cinco repeticiones. Cada unidad experimental estaba constituida por 1000 plántulas, haciendo un total de 5000 plantas para cada tratamiento y 10000 en todo el experimento. Duración del experimento El experimento duró 190 días (desde septiembre de 2001 a abril de 2002), período en el cual se estima que las plantas de tembe en vivero, alcanzan un desarrollo apropiado para ser transplantadas a campo. Sustrato El sustrato base utilizado en el experimento fue una mezcla de 50 % de limo, 30 % de suelo del lugar, 10 % de cascarilla de arroz y 10 % de aserrín. El sustrato fue desinfectado con vapor de agua en la Estación Experimental “La Jota” del Proyecto IBTA Chapare, para asegurar que en el tratamiento sin inoculación no esté presente ninguna fuente de inóculo micorrícico. En ambos tratamientos se utilizó el mismo sustrato base. Inoculación En el tratamiento con inoculación, se utilizó como inoculante una mezcla de propágalos que incluían raíces de kudzú (Pueraria phaseoloides) colonizadas por micorrizas, suelo superficial y hojarasca con esporas. El inoculante fue extraído de una parcela sembrada con kudzú, que mostraba un crecimiento vigoroso. Para verificar que la fuente de inóculo era apropiada, se realizó una evaluación de colonización micorrícica siguiendo la metodología sugerida por Sylvia (1994). No se hizo ninguna cuantificación del número de esporas del sustrato, aunque se evidenció la presencia de esporas de micorrizas en el suelo superficial, aunque no se realizó su identificación taxonómica. Se decidió utilizar raíces de kudzú debido a que Ruiz (1994) encontró que la utilización de ese material en viveros de palmito en la amazonia peruana, promovió mayor infección micorrícica que hojarasca de bosque o que raíces de Inga spp. Para la preparación del sustrato en el tratamiento con inoculación, se mezcló una parte de fuente de inóculo con dos partes de sustrato base, en volumen. En el tratamiento sin inoculación, sólo se empleó sustrato base desinfectado. Variables de respuesta Durante el período de evaluación del experimento se evaluaron diferentes variables de respuesta; un detalle de las mismas se presenta en el Cuadro 1. Cuadro 1. Variables de respuesta evaluadas en el experimento, frecuencia de evaluación y número de plantas evaluadas por tratamiento.
* El análisis de tejidos se realizó en el Laboratorio de Suelos y Tejidos del CIAT, Santa Cruz. Para evaluar la colonización por micorrizas de las raíces de las plantas de tembe, se extrajeron muestras de raíces directamente de las bolsas usando un sacabocados. Las muestras fueron lavadas con agua, acondicionadas en una solución de formol, ácido acético y alcohol hasta el momento del análisis de laboratorio. La estimación de la colonización de raíces de tembe por hifas de hongos micorrícicos se realizó por el método descrito por Sylvia (1994). Manejo de las plántulas en vivero Las semillas germinadas fueron transplantadas a bolsas de 13*18 cm que contenían sustrato inoculado y sustrato no inoculado. Las bolsas fueron acomodadas en platabandas en un vivero con semisombra de 70 % proporcionada por una malla saram. Cuando hubo necesidad, todas las plantas fueron regadas diariamente, con regadera, en dos oportunidades. Una vez que comenzó la temporada de lluvias, el riego fue eliminado. Para control de enfermedades foliares se realizaron dos aplicaciones de funguicidas cúpricos. No se efectuó ninguna fertilización durante el experimento y se realizaron tres deshierbes manuales. Resultados y discusión Colonización micorrícica de raíces de kudzú El estudio de laboratorio mostró que 83.2 % de las raíces de kudzú evaluadas estaba colonizado por hifas y vesículas. En las raíces colonizadas, se estimó que un 90 % de su longitud contenía hifas de micorrizas. Estos resultados muestran claramente que en el estudio se empleó una fuente de inóculo apropiada. En este trabajo no se identificó todos los géneros de micorrizas presentes, aunque se pudo observar esporas características del género Glomus. Colonización micorrícica de raíces de tembe Las raíces de las plantas
que no recibieron el tratamiento de inoculación no presentaron ninguna
infección micorrícica, lo que evidencia una buena desinfección del
sustrato con vapor de agua. En cambio, las raíces de las plantas
inoculadas fueron infectadas por las micorrizas del inóculo. En la primera
evaluación efectuada 34 días después del transplante a vivero, sólo 5 % de
las raíces evaluadas estaban micorrizadas, mientras que a la finalización
del experimento (190 días) la mitad de las raíces mostró presencia de
hifas de micorrizas en sus raíces y las raíces micorrizadas tenían cerca
de 50 % de su longitud colonizada con hifas (Cuadro 2). Es de destacar que
no se encontraron vesículas de micorrizas, estructuras de reserva que
generalmente aparecen en plantas más viejas.
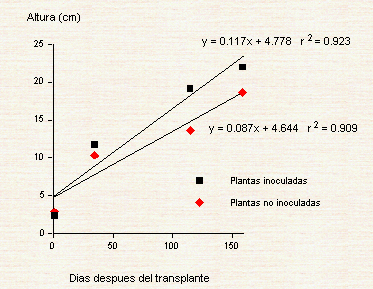
Altura de plantas de tembe Al inicio del experimento, la altura de las plantas en los dos tratamientos fue estadísticamente similar (P<0.05). A partir de los 34 días después del transplante y hasta la finalización del ensayo (190 días después del transplante), la altura fue significativamente mayor (P<0.0001) en las plantas inoculadas (Figura 1). En forma similar a estos resultados, Sudo et al. (1996) encontraron que plantas de tembe inoculadas con micorrizas fueron 45 % más altas que plantas no inoculadas. Figura 1. Variación de la altura promedio de plántulas de tembe para palmito, desde el transplante hasta 190 días después, en plántulas inoculadas con micorriza y no inoculadas. Las barras sobre los promedios corresponden a la Diferencia Mínima Significativa (DMS) (α = O.05). Hasta los 158 días del experimento, las plantas micorrizadas presentaron mayor altura que las plantas no micorrizadas, pero después de esa fecha la diferencia de altura fue mucho más marcada (Figura 1). Hasta los 158 días, la tasa de crecimiento de las plántulas inoculadas fue de 0.117 cm/día y de 0.087 cm/día en las plantas no inoculadas (Figura 2). El marcado incremento en altura después de los 158 días pudo deberse a incrementos importantes en los porcentaje de raíces colonizadas y de longitud de raíz colonizadas por hifas, tal como se presenta en el Cuadro 2.
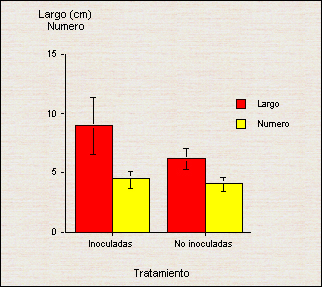
Tamaño y número de hojas El tamaño de las hojas en las plantas inoculadas fue, en promedio, 45 % mayor que en las no inoculadas (P<0.001). Asimismo, el número de hojas en las plantas inoculadas fue 11 % mayor (P<0.001) en las plantas inoculadas (Figura 3). Las mediciones del largo y el número de hojas se efectuaron a los 114 y 190 días después del transplante a vivero, respectivamente.
(Las líneas sobre las barras corresponden a la desviación estándar de la media). En Brasil, Sudo et al.
(1996) encontraron que plantas de tembe inoculadas presentaron 180 % más
área foliar que plantas no inoculadas. También observaron que las plantas
inoculadas tenían sus hojas más jóvenes completamente desarrolladas de un
tamaño 45 % mayor que las de las plantas no inoculadas. Cuando las plantas estuvieron en condiciones de ser transplantadas a campo (190 días después del transplante a vivero), se estimó la biomasa seca de la parte aérea (hojas y tallo) y de las raíces. Las plantas inoculadas presentaron tres veces más biomasa aérea y dos veces más biomasa radicular que las plantas no inoculadas (Cuadro 3, Fotografía 2). Sin embargo, la relación de raíz/parte aérea en las plantas micorrizadas fue menor que en las plantas no micorrizadas (Cuadro 3). De acuerdo con Marschner (1995) este fenómeno es una respuesta típica de plantas con mayor acceso a nutrimentos en el sustrato; el crecimiento de la parte aérea es más pronunciado que el crecimiento de raíces, conduciendo a una menor relación raíz/parte aérea. Cuadro 3. Promedios de biomasa en plantas de tembe inoculadas y no inoculadas con micorrizas.
Promedio dentro columnas seguidos por diferentes letras, difieren entre sí (P<0.001); prueba de t.
Acumulación de nutrimentos La acumulación de macro y micro nutrimentos fue significativamente mayor, tanto en la parte aérea como en raíces, en las plantas inoculadas que en las no inoculadas (Cuadro 4). En la biomasa aérea las plantas inoculadas mostraron incrementos, en comparación con las plantas no inoculadas, de 296 % en N, 155 % en P, 94 % en K, 77 % en Ca, 131 % en Mg, 60 % en S, de 280 % en Fe, 491 % en Mn, 276 % en Cu, 300 % en Zn y 246 % en B. En un experimento similar realizado en Brasil, Sudo et al. (1996), encontraron que plantas de tembe para palmito inoculadas con dos especies de micorrizas del género Glomus, contenían 159 % más de N, 70 % más de P y 80 % más de K que plantas no inoculadas. En la amazonía peruana, Ruiz (1994) también encontró una mayor acumulación de macro nutrimentos en plantas de tembe para palmito inoculadas con micorrizas. Cuadro 4. Acumulación de macro y micro nutrimentos en la biomasa aérea y de raíces de plantas de tembe, inoculadas y no inoculadas con micorrizas.
** En la versión impresa de este artículo -por equivocación atribuible exclusivamente al Comité Editor- se indica erróneamente la unidad g/planta para la variable "Parte aérea", siendo lo correcto la unidad detallada en el Cuadro 4, es decir "Gramos de nutrimento/biomasa seca de 1000 plantas". Está bien documentado en la literatura que las micorrizas incrementan principalmente la absorción de iones que se difunden lentamente y están presentes en bajas concentraciones en la solución del suelo, como es el caso del P, Zn y Cu (Marschner, 1995; Sánchez de Prager, 1999), mientras que su rol en la adquisición de N, Ca, Mg y otros nutrimentos no está bien estudiado (Marschner, 1995). Uno de los factores asociados a la mayor absorción de nutrimentos en plantas micorrizadas es la presencia de una mayor superficie de absorción gracias a la formación de una red de hifas externas que pueden explorar un mayor volumen de suelo. Al respecto, Marschner (1995) citando a Jakobsen et al. (1992) indica que el rango de longitud de las hifas externas es entre 1 y 10 m por centímetro de raíz infectada. Otros factores que favorecen la absorción de nutrimentos en plantas micorrizadas es una mejor distribución en el suelo de la red de absorción, la geometría más favorable de las hifas (diámetro mucho menor a las raíces: 1-12 µm y alteraciones químicas en la rizosfera (Miranda y Miranda, 1997). Conclusiones ● La inoculación con micorrizas permitió obtener plantas con raíces colonizadas por micorrizas, que mostraron tener un mayor desarrollo de la parte aérea y de las raíces y mayores concentraciones de macro y micro-nutrimentos esenciales que plantas sin inoculación. ● La utilización de raíces colonizadas de kudzú, mezcladas con hifas y esporas mostró ser una fuente de inóculo efectiva para su utilización en sistemas de producción de plantas de tembe para palmito en vivero. Referencias citadas MARSCHNER, H. 1995. Mineral nutrition of higher plants. Second edition. Academic Press. 889 p. MIRANDA, J., MIRANDA, L. 1997. Micorriza arbuscular. In: Milton Alexandre Teixeira vargas y Mariangela Hungria (eds.). Biología dos solos dos Cerrados. EMBRAPA, Brasil. pp. 69-1 23. MORA-URPÍ, J., GAINZA, J. (eds.). 1999. Palmito de pejibaye (Bactris gasipaes Kunth): su cultivo e industrialización. San José, Costa Rica, Editorial de la Universidad de Costa Rica. 260 p. RUIZ, P. 1994. Effects of site managementon vesicular arbuscular mycorrhiza fungi on soil phosphorous fractions in Ultisol of the Peruvian Amazon. Ph.D. Dissertation, North Carolina State University, Raleigh, North Carolina. 228 p. SÁNCHEZ DE PRAGER, M. 1999. Endomicorrizas en agroecosistemas colombianos. Palmira, Colombia, Universidad Nacional de Colombia. 227 p. SUDO, A., da SILVA, E., BOVI, M., de ALMEIDA, D., COZZOLINO, K. 1996. Produçáo de mudas de pupunheira colonizadas por fungos micorrizicos arbusculares. Revista Brasileira da Ciéncia do Solo 20: 529-532. SYLVIA, D. 1994. Vesicular-arbuscular mycorrhizal fungi. In: R. Weaver et al. (eds.). Methods of soil analysis. Part 2. Microbiological and biochemical properties. Soil Science Society of America. pp. 35 1-378. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||