|
Antecedentes Tomando en cuenta la gran biodiversidad y tradición de uso de plantas medicinales en Bolivia, así como la revolución que están produciendo los fitofármacos en la industria farmacéutica y el mercado internacional, se genera la necesidad de realizar estudios de desarrollo e investigación, cultivos e industrialización de estos recursos naturales, como un aporte de todas estas áreas mencionadas al desarrollo de Bolivia, en cadenas productivas. Así, se generó una alianza estratégica entre Institutos de investigación de la UMSA (Instituto de Investigaciones Químicas e Instituto de Biología Molecular y Biotecnología), la empresa farmacéutica LAFAR S.A. y una ONG FHI-Bolivia, con la finalidad de elaborar productos fitofármacos bolivianos de alta calidad en base a una investigación de los mismos a diferentes niveles: investigación de usos tradicionales, investigación científica, investigación de requerimientos para su industrialización, investigación de mercado, investigación de procesos de manufactura y control de calidad. Es así que considerando que el éxito de estos productos fitofármacos radica en su respaldo científico, de manera que puedan ser puestos en mercados del interior y exterior del país respetando las normas establecidas en cada uno de los países, se trazó como objetivo central la identificación de potenciales productos fitofármacos en base a estudios químicos y biológicos preliminares de plantas medicinales de Bolivia. Una vez determinados estos potenciales productos fitofármacos estos pasarían a estudios científicos más profundos y a la empresa LAFAR S.A., donde se los transformaría en formas farmacéuticas convenientes y se realizarían las actividades complementarias para la obtención del Registro Sanitario, de acuerdo a las regulaciones establecidas por la DINAMED, como Autoridad Reguladora de Medicamentos en Bolivia. En el presente trabajo se presenta la identificación de tres potenciales productos fitofármacos: ChiIl’kha, Macho Altea y Altamisa. Así como los estudios químicos y biológicos profundos que se realizaron de los mismos y los primeros pasos en la obtención del Registro Sanitario de la ChiIl’kha. Metodología Material vegetal Las plantas de este estudio fueron colectadas en áreas rurales, cercanas a las ciudades de los departamentos de La Paz, Cochabamba y Potosí, el año 2002. Al realizar la recolección del material vegetal también se hizo una recopilación de información del uso tradicional de la planta en el lugar. Los especimenes fueron identificados por expertos del Herbario Nacional de Bolivia donde se pueden encontrar muestras depositadas. Obtención de extractos Las plantas fueron secadas a temperatura ambiente, en una habitación ventilada evitándose una exposición directa a la luz solar, y luego fueron pulverizadas. El material vegetal, seco y molido, fue sometido a una extracción fraccionada con solventes de diferente polaridad. El primer paso fue someterlas a maceración con Eter de Petróleo por 72 horas, con renovación de solvente, para dar los extractos etéreos. El residuo vegetal luego fue macerado con Etanol al 96 % durante 72 horas y el extracto etanólico obtenido se llevó a sequedad por rotaevaporación. Estudios químicos preliminares Se realizaron las siguientes pruebas descritas por Ciulei (1977): Para Terpenoides se utilizó el método de Libermann Buchard. La prueba también da positivo para Carotenoides. Para Flavonoides, se utilizó el método de Shibata. Esta prueba se puede confirmar por análisis en Cromatografía en Capa Fina revelada con H al 10 %. Para Alcaloides se utilizó el reactivo de Mayer y Dragendorif. Para Taninos Gálicos y Cotecólicos, se utilizó el método de precipitación de Cloruro férrico. Para Flavonas Glicosídicas; se utizó la reacción de Shibata, después de una hidrólisis ácida al extracto. Para Antraquinonas se realizó la determinación a través de Cromatografía en Capa Fina en CH revelado con una solución de Kl al 5% en MeOH. Las saponinas se identificaron mediante agitación del extracto etanólico disuelto en agua durante 15 minutos en el equipo Vortex. Aislamiento y elucidación estructural de compuestos Los estudios fitoquímicos profundos, de algunas plantas elegidas, condujeron al aislamiento y elucidación estructural de los componentes mayoritarios de los extractos elegidos. Para el aislamiento se utilizaron técnicas comunes de cromatografía como la cromatografía de adsorción en columna abierta (CC), la cromatografía líquida la vacío (VLC) y la Cromatografía de Exclusión Molecular en Sephadex LH-20. La elucidación estructural se realizó principalmente en base a técnicas espectroscópicas como IR (Infrarrojo), UV (Ultravioleta), EM (Espectrometría de masas) y RMN 1D y 2D (Resonancia Magnética Nuclear mono bidimensional). Capacidad antioxidante ABTS Para la determinación de la capacidad antioxidante se utilizó el test colorimétrico ABTS. Este test se basa en la formación de un complejo y esencialmente busca “scavengers” o atrapadores de radicales libres, como peróxidos, que es la principal causa de oxidación a nivel celular (Hiroshi et al. 1979 y Hiroyuki et al., 1984). Es un método de screening para la evaluación de la capacidad antioxidante de distintos compuestos comprendiendo tanto sustancias hidrofílicas como lipofílicas. Ensayos antibacterianos Se utilizaron las siguientes bacterias: Staphylococcus aureus ATCC 25123 y Echerichia co!i ATCC 25922. Para la evaluación del extracto y compuestos puros se utilizó el método de dilución en medio sólido de Mitcher (CYTED 1995), mezclando el medio Agar Muller Hinton con el extracto en estudio (1 mg/mI) e inoculando con 10 ml de cada una de las suspensiones bacterianas. Ensayos de genotoxicidad Para determinar genotoxicidad y actividad antimutagénica se utilizó el método de mutación y recombinación somática de SMART en Drosophila melanogaster (Frei y Wúrgler, 1988), este es un ensayo in vivo, rápido y con gran potencial de aplicación en estudios de genotoxicidad básicos y aplicados. Por el ensayo de SMART se deben determinar las mutaciones en las alas expresadas en manchas simples o manchas que sugieren un efecto recombinogénico. Determinación del efecto antimutagénico (in vitro) Se ha utilizado, el ensayo de mutagenicidad por incorporación en placa (Graf et al., 1984 y Maron et al., 1983) usando cepas de Salmonella typhimurium (TA102), para establecer la antimutagenicidad del extracto de Hypsseocharis pimpinellifo!ia, ya que posee alta sensibilidad a una variedad de sustancias que producen daño oxidativo. Resultados y discusión Para la identificación de potenciales productos fitofármacos se han seleccionado 12 especies vegetales en base a: 1) Listas de plantas aprobadas por la legislación boliviana como medicamentos naturales tradicionales; 2) Disponibilidad física de plantas utilizadas en medicina tradicional en las zonas de intervención de FHI en Bolivia y 3) Recopilación de informaciones de uso tradicional de las plantas en el lugar. De estas especies se han realizado los siguientes estudios químicos preliminares: I) Determinación de tipos de metabolitos secundarios en extractos etéreos y etanólicos (Cuadro 1), II) Determinación de rendimiento de extractos y III) Determinación de complejidad química mediante cromatografía en capa fina y los siguientes estudios biológicos: Determinación de toxicidad general y actividad antioxidante. Como resultado de estos estudios se determinaron tres especies como potenciales productos fitofármacos: Chill’kha, de gran disponibilidad física, ampliamente utilizada como antiinflamatorio a nivel nacional (Girault, 1989), con presencia de flavonoides en su extracto etanólico y no presenta toxicidad general. Macho Altea, raíces altamente utilizadas en la zona del norte de Potosí (Peñarrieta, 2002) y con una interesante actividad antioxidante preliminar y Altamisa, de gran disponibilidad física en La Paz, uso tradicional reconocido como analgésico (SECAB & Ministerio de Educación y Ciencias de España & CAF, 1990) y altos rendimientos de terpenoides. Cuadro 1. Estudio fitoquímico preliminar de extractos etanólicos.
(+) positivo; (-) negativo; Al: Alcaloides, F: Flavonoides, T: Terpenoides; S: Saponinas; An: Antraquinonas; TaGa Taninos Gálicos; Taco: Tanino Cotecólicos Todos los ensayos fueron confirmados por cromatografía en capa fina. Los tres potenciales productos fitofármacos fueron nuevamente recolectados y sometidos a procesos de extracción dando los rendimientos mostrados en el Cuadro 2. Posteriormente, los extractos fueron sometidos a estudios más profundos desde el punto de vista químico y biológico, que se describen a continuación. Cuadro 2. Rendimientos de extractos.
Ensayos biológicos de los tres potenciales productos fitofármacos Para determinar la actividad antibacteriana, se probaron los extractos etanólicos contra dos tipos de bacteria: una gram(+) Staphylococcus aureus y una gram(-) Echerichia coli. dando los resultados del Cuadro 3, donde se puede observar que el único extracto positivo fue el de Macho Altea, del que se determinó un MIC de 30 µg/mL. Cuadro 3. Ensayos antibacterianos de los extractos etanólicos.
concentración: 1 mg/mL; S. aureus cepa ATCC 25123; E. coli cepa ATCC 25922 En cuanto a la actividad antioxidante, se evaluaron tanto los extractos etéreos como los etanólicos de las tres especies vegetales por el test ABTS, reduciendo la concentración de aquellos extractos que presentaron una actividad importante. En el Cuadro 4 se puede ver que la mayor actividad se presentó en el extracto etanólico de la raíz de Macho Altea, que muestra un porcentaje de inhibición incluso mayor al del patrón Quercetina. Esta actividad es atribuida a la gran presencia de taninos gálicos determinados en el estudio fitoquímico preliminar. Cuadro 4. Actividad antioxidante, método decoloración por ABTS.
concentración inicial 3000 µM, ET (Extracto Etanólico), EP (Extracto de Eter de Petróleo) Para determinar genotoxicidad se utilizó el método de mutación y recombinación somática de SMART en Drosophila melanogaster, un ensayo in vivo, rápido y con gran potencial de aplicación en estudios de genotoxicidad (Frei y Wúrgler, 1988). La Baccharis latifolia “Chill’kha” testada por ensayo SMART de alas en cruce estándar muestra manchas simples pequeñas pero no son significativas, lo que sugiere un efecto no mutagénico, los resultados fueron validados por laboratorios de la Universidad de Rio Grande do Sul (Brasil). El extracto etanólico de Hypseoccharis pimpinellifolia “Macho Altea” también he sido evaluados por este test, mostrando la curva de sobrevivencia que el extracto no es tóxico a concentraciones hasta de 25 mg/mL (Cuadro 5). Cuadro 5. Datos de toxicidad en D. melanogaster de H. pimpinellifolia y B. latifolia.
Para detectar el posible efecto del extracto de Hypseoccharis pimpinellifolia como agente antimutagénico, se ha desarrollado el ensayo de incorporación en placa con Salmonella thypimurium, cepa TA1O2, ya que posee alta sensibilidad a una variedad de sustancias que producen daño oxidativo. Para estimar su actividad antimutagénica se realizó un cotratamiento del extracto con un agente mutagénico inductor de radicales libres H2O2. El Cuadro 6 muestra que el extracto disminuye drásticamente el N° de revertantes a las concentraciones de 2 y 20 µg/mL. Cuadro 6. Resultados de H. pimpinellifolia en el test de AMES.
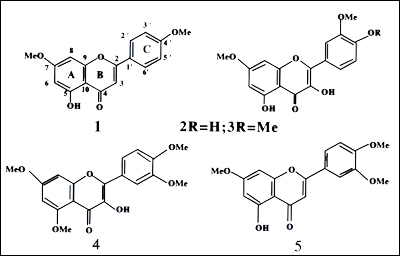
Aislamiento y elucidación estructural de compuestos de los potenciales productos fitofármacos Finalmente continuando el estudio de las plantas seleccionadas, se logró el aislamiento e identificación de cinco flavonoides de la Chill’kha (Baccharis latifolia) y un sesquiterpeno de Altamisa (Franseria artemisoides). La identificación estructural de los cinco flavonoides se basó principalmente en los espectros de RMN13 y 1H que mostraban claramente sistemas aromáticos típicos de flavonoides los cuales fueron confirmados con datos bibliográficos (Salcedo et al., 2001) y experimentos de RMN 2D.
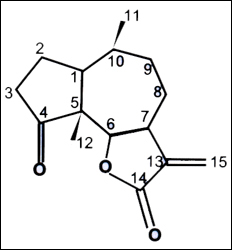
Del potencial producto fitofármaco Altamisa o Franseria artemisoides se aisló un sesquiterpeno muy interesante: Damsin, con reportada actividad antineoplásica (DNP 2002), cuya estructura también fue determinada principalmente por datos de RMN y fue confirmada por comparación con datos bibliográficos (Ah et al., 1989).
Registro sanitario Finalmente, debido a que la Chill’kha es la planta con mayor cantidad de antecedentes científicos y más conocida a nivel popular se decidió continuar con los trabajos de esta planta necesarios para la obtención del registro sanitario. Como primera etapa, se elaboró el producto en su forma farmacéutica, crema CHILLKHAFLAM, en la unidad de producción de industrias LAFAR SA, luego la crema fue sometida a un estudio clínico a nivel dermatológico en el Hospital de Clínicas dando buenos resultados como antiinflamatorio pero produciendo en algunos casos alergias leves. Posteriormente el producto fitofármaco fue sometido a la comisión de Evaluación farmacológica de la DINAMED, para lo que se realizó una monografía en base a nuestras investigaciones y otras realizadas en la misma planta. Sin embargo, este es un trabajo que todavía requiere ser complementado de acuerdo a las observaciones realizadas por la entidad reguladora. Conclusiones De acuerdo a las investigaciones realizadas, se ha determinado los siguientes potenciales productos fitofármacos: Chill’kha, presenta una gran disponibilidad física, tiene un reconocido uso tradicional como antiinflamatorio, los estudios de genotoxicidad de extractos orgánicos muestran que no es genotóxico y se conoce su composición química, con una gran presencia de flavonoides. Soltaqui o Macho Altea, tiene un reconocido uso en las comunidades del norte de Potosí y su extracto etanólico presenta una alta actividad antioxidante, incluso mayor al compuesto utilizado como control (quercetina), además de una interesante actividad antinutagénica, ambas actividades atribuidas a la presencia de flavonoides y taninos. Altamisa, tiene una elevada proporción de Damsin, un sesquiterpeno de reconocida actividad antioneoplasica y de fácil aislamiento en la planta. Referencias ALI A. A., ABDALLAH O. M., STEGLISH, W. 1989. Pharmazi, pp. 44, 800-801. CIULEl, 1. 1977. Methodology for Analysis of Vegetable Drugs, Faculty of Pharmacy, Bucharest, Rumania. CYTED. 1995. Manual de Técnicas de Investigación. pp. 63. DIRECCIÓN NACIONAL DE MEDICAMENTOS — MINISTERIO DE SALUD Y PREVISIÓN SOCIAL, BOLIVIA. 2002 Normas para Medicamentos Naturales, Tradicionales y Homeopáticos. DNP. 2002. Dictionary of Natural Products. Version 10:2. Chapman & May. FREI, H. y WÚRGLER, F. 1988. Mutat. Res. pp. 203, 297-308. GIRAULT, L. 1989. Kallawaya curanderos itinerantes de los Andes. UNICEF-OPS-OMS. pp. 480. GRAF, U., WURGLER, A. J., KATZ, A. J., FREI, H., JUON, H., HALL, C. B. y KALE, P. G. 1984. Environ. Mutagen. pp. 6, 153-188. HIROSHI, O., NOBUKO, O. y KUNIO, Y. 1979. Analytical Biochemistry. pp. 95, 351. HIROYUKI A. y YOKO, A., 1984. Phytochemistry, 23, 2875-28884 MARON, D. y AMES, B. 1983. Mutat. Res. pp. 113, 173-215. PEÑARRIETA, M. 2002. Entrevistas a comunarios en la Localidad de Cuturi, provincia Chayanta. SALCEDO, L., STERNER, O. y ALMANZA G. 2001. Rey. Bol. Quim. pp. 18, 43. SECAB & MINISTERIO DE EDUCACIÓN Y CIENCIAS DE ESPAÑA & CAF. 1990. Especies promisorias de los países del Convenio Andrés Bello, Tomo V. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||