|
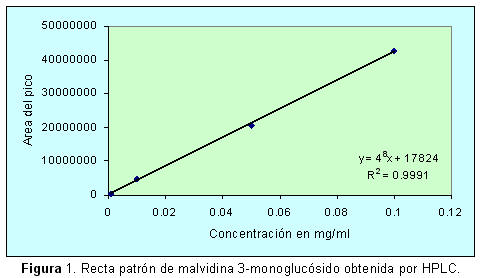
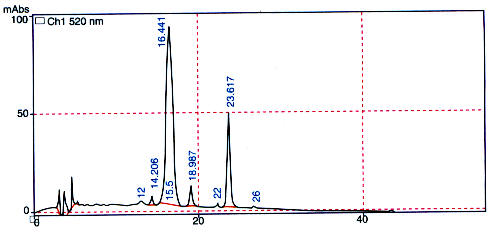
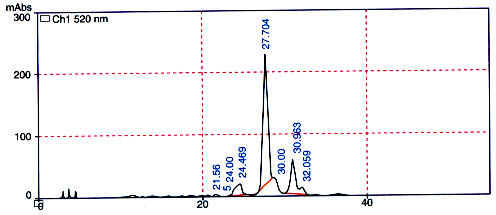
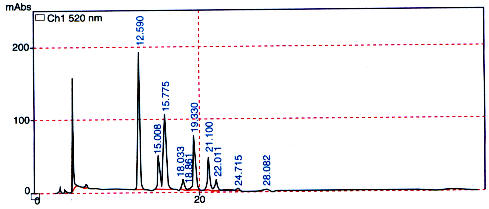
Introducción La calidad de un alimento depende principalmente de su valor nutritivo pero sus características organolépticas son muy importantes; por su aspecto, forma y color, el consumidor establece un primer contacto con los alimentos y más tarde con su textura y sabor. Ciertos alimentos al ser procesados pierden color, por lo que la industria alimenticia ve la necesidad de adicionarles sustancias colorantes, en su gran mayoría sintéticas, por lo que para ellos es indispensable contar con colorantes naturales cuyos costos de producción sean competitivos y que sustituyan a los artificiales, los que por su toxicidad son altamente cuestionados por los consumidores. Los antocianos, grupo de compuestos fenólicos, pertenecientes a la familia de los flavonoides, han ido adquiriendo cada vez más importancia debido a sus dos propiedades: sus características colorantes y su capacidad antioxidante, estos pigmentos vegetales son los responsables de los colores rojo, azul y violeta de la mayoría de flores y frutos y que hoy en día están incluidos en las listas positivas de los colorantes de la Unión Europea representando una alternativa al colorante amaranto, prohibido en Estados Unidos debido a que produce efectos adversos tales como urticaria, prurito, angio-edema e incluso bronco-constricción si se combina con otros colorantes. Los antocianos se presentan como una alternativa a dicho colorante sintético y también como alternativa al rojo allura (FD&C Red 40), que aunque autorizado por la FDA, está prohibido por la Unión Europea ya que se está asociado con la aparición de tumores. Los antocianos presentan una estabilidad muy baja ya que se degradan a determinado pH, temperatura, por incidencia de la luz, presencia de oxígeno y otros factores, sin embargo se ha evidenciado que ciertos patrones de sustitución de los antocianos favorecen una mayor estabilidad de los mismos, por lo que se ve la necesidad de buscar nuevas fuentes, diferentes de las tradicionales (uvas, ciruelas y otros) que proporcionen compuestos más estables para su uso como colorantes. Bolivia al ser considerada como uno de los ocho centros más importantes de biodiversidad y domesticación de plantas cultivadas en el mundo, junto a otros países andinos, es uno de los principales y más antiguos centros de domesticación de tubérculos. Debido a esto, De Groot (1994) y Rivero (1997), realizaron investigaciones preliminares, encontrando como fuentes factibles de colorantes antociánicos a algunas variedades de tubérculos andinos, debido al contenido relativamente alto de pigmento. El hecho de que estos pigmentos estén presentes en la dieta humana y animal a través de estos tubérculos comestibles, los convierte en buenos candidatos para su uso como colorantes alimentarios. Materiales y métodos El Chiar Isaño (Tropaeolum tuberosum), Papa Pinta Boca (Solanum stenotonum) e Isla Oca (Oxalis tuberosa) provenientes de la micro-región de Candelaria (Cochabamba) fueron proporcionados por la Fundación PROINPA (Fundación para la Promoción e Investigación de Productos Andinos). La limpieza y selección de los tubérculos se realizó manualmente, lavándose por fricción en agua corriente, liberándolas de cualquier material extraño adherido a la cáscara. Así mismo, se retiró el material vegetal que presentó daños exteriores o mostró señales de putrefacción. Los tubérculos seleccionados se sumergieron en agua en ebullición por un tiempo de 15 minutos. Se separó el agua del hervido, dejándose enfriar el material vegetal, procediéndose luego a retirar la zona de mayor pigmentación por remoción manual de la piel y la pulpa coloreada con ayuda de un cuchillo, triturándose posteriormente en un procesador de alimentos obteniéndose el "preconcentrado"; el que fue congelado a -24 OC y liofilizado en un tiempo aproximado de 72 horas; finalmente se realizó la molienda hasta consistencia de polvo fino, obteniéndose los concentrados respectivos. Preparación de la muestra para análisis En todos los casos, se disolvió el concentrado en agua ácida a pH 0.5 y se realizó una extracción en fase sólida (SPE) en cartuchos Cl 8 de fase reversa (Sep.pack) para remover almidón, azúcares y otras sustancias interferentes. Cuantificación de antocianos por HPLC-DAD La cuantificación de antocianos por HPLC-DAD se llevó a cabo por comparación de las áreas de los picos obtenidos en el cromatograma, con una recta patrón realizada con el antociano malvidina 3 mono-glucósido en todos los casos debido a la dificultad que supone disponer de patrones distintos de antocianos, tanto por cuestiones económicas como de oferta de los mismos. Además, la utilización del mismo patrón en la cuantificación de los antocianos totales de los tres tubérculos, permite la obtención de resultados comparables. Se prepararon disoluciones seriadas a partir de una solución madre de monoglucósido de malvidina en agua ácida a pH 0.5 la concentración de las disoluciones hijas fue de 0.1, 0.05, 0.01 y 0.001 mg/ml. Las inyecciones de dichas disoluciones se efectuaron en el equipo de cromatografia HP 1050, con las siguientes condiciones de trabajo: Fase estacionaria: Columna Waters Spherisorb de fase reversa, 3Mm ODS2 (4.6x150mm). Fase Móvil: Ácido fórmico al 4.5% (A) Acetronilo (B) Flujo: 0.5 ml/min. Gradiente: 10% B a 20% B en 20 min. 20% B a 25% B en 10 min. 25% B a 35% B en 10 min. 35% B durante 10 min. 35% B a 10% B en 10 min. 10% B durante 5 min. Detección: Mediante detector de diodos a 520 nm. Detector de diodos UV-Vis Shimadzu SPD-M 10Avp. La recta patrón obtenida luego de la inyección de las cuatro disoluciones hijas se observa en la figura 1, donde la ecuación de la recta es: y = 17824 + 48 x el coeficiente de regresión (R2) tiene un valor próximo a 1, lo que indica que existe un buen ajuste de los puntos de la recta. Una vez que se ha obtenido la recta patrón y se ha calculado la ecuación de la misma, se procede a inyectar en HPLC la disolución de la muestra que se va a cuantificar. Se debe hacer una disolución tal, que el valor total del área del pico se encuentre dentro del intervalo de valores de la recta patrón. La inyección de la muestras fue de 150 ml de la disolución de 4 mg/ml del concentrado de cada uno de los tubérculos. Para cada concentrado se obtuvo un cromatograma, en el que se procedió a integrar los picos principales, obteniéndose un valor de área para cada pico del cromatograma, se sumaron todas las áreas y este valor del área total se llevó directamente sobre la recta patrón o bien a la ecuación de la recta, obteniéndose el contenido total de antocianos expresado en mg de mono-glucósido de malvidina por ml de solución preparada. Teniendo en cuenta los factores de dilución y conociendo el peso del concentrado del que se partió para hacer la disolución madre, se calculó el porcentaje que representa el monoglucósido de malvidina respecto al concentrado del tubérculo (gramos de monoglucósido de malvidina que hay en 100 gramos de concentrado). Resultados y conclusiones Los cromatogramas obtenidos por HPLC-DAD a 520 nm para cada tubérculo estudiado se puede observar en las Figuras 2, 3 y 4. Los valores de las áreas y los porcentajes calculados se observan en las tablas 2 y 3 respectivamente. Por primera vez se ha realizado un estudio sobre la cuantificación de antocianos por HPLC de los tres tubérculos andinos, los que proporcionan valores superiores a los obtenidos por fotometría. De los tres tubérculos analizados, el que presenta un mayor contenido de antocianos totales es el correspondiente a la Papa, seguida por el Isaño y en último lugar la Oca. Los tres tubérculos estudiados podrían ser considerados como recursos agroindustriales para el desarrollo de alternativas viables en la producción de colorantes naturales, por su alto contenido de pigmentos y su bajo costo. Tabla 1. Valores de áreas de las soluciones patrón.
Tabla 2. Valores de áreas de los cromatogramas de los concentrados.
Tabla 3. Porcentaje de malvidina-3-glucósido en los concentrados.
Referencias BELITZ, H.D., GROSCH, W., (1998),"Química de los Alimentos"; Editorial Acribia. CHMIELEWSKA, I., (1935) "Pigments of Violet Potatoes", Roczniki Chem., 15, 491-505. DE GROOT, W., (1994) "Informe de Labores, Centro de Tecnología Agroindustrial, Universidad Mayor de San Simón, Cochabamba, Bolivia. MARCANO, D.(1989) " Introducción a la Química de los Colorantes", Ed. Reverté Venezolana, Caracas, Venezuela, IBTA-PROINPA(1993). OBLITAS, E., (1992) "Plantas Medicinales en Bolivia (Farmacopea Kallawaya)" 2da. Ed.; Editorial Los Amigos del Libro", Cochabamba, Bolivia; 163, 279. RIVERO, P., (1997) "Aislamiento, Cuantificación y Pruebas de Estabilidad del Pigmento azul-violeta contenidos en algunas especies de Tubérculos Nativos, Tesis de Grado, Facultad de Ciencias y Tecnología; Universidad Mayor de San Simón, Cochabamba, Bolivia. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||