|
1. Introducción
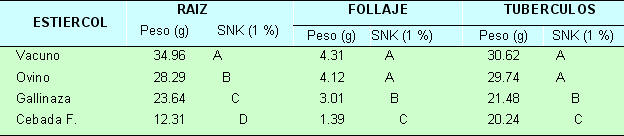
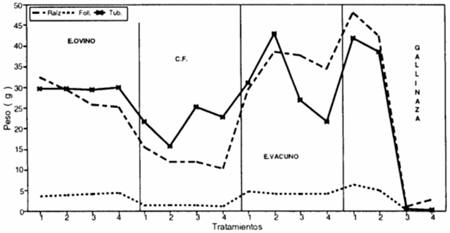
El ataque de nemátodos en la región andina representa un gran problema para el cultivo de la papa. N. aberrans causante del "rosario" de la papa ocupa. el primer lugar, porque las pérdidas en terrenos medianamente infestados pueden llegar a 40% en el rendimiento total y un 60% de la producción de tubérculos grandes (Otazu et al 1982). Por otra parte la producción de tubérculos-semilla de papa en las categorías básica, registrada y certificada no tolera la presencia de nódulos (Consejo Nacional de Semillas, 1990). Los nemátodos una vez establecidos en un terreno, su erradicación es imposible (Sasser, 1987). Por lo tanto el uso integrado y racional de todos los métodos de control (cultural, físico, químico, biológico, genético y legal) es la única manera de reducir las poblaciones y pérdidas ocasionadas por estos (Canto, 1987). El CONTROL ó MANEJO BIOLOGICO día a día, adquiere mayor importancia por el concepto ecológico que implica su uso, el mismo que es ejercido por organismos con características de PARASITOIDES, PREDATORES y PATOGENOS (Cisneros, 1986). Este combate se origina en el suelo y pueden seguirse dos caminos: 1o Inoculación con microorganismos específicos o 2o Favorecer el desarrollo de microorganismos antagónicos que naturalmente se encuentran en el suelo (Herbas,1981). Beauveria spp. se encuentra distribuido en todo el mundo (Brady,1979), sin embargo en el Perú B. brongniartii está distribuido en zonas de la sierra (Torres, 1991). Por las características patogénicas y saprofíticas del hongo Beauveria brongniartii, se ha elegido a este para determinar su eficiencia como biocontrolador de Nacobbus aberrans. Sin embargo para cumplir con este objetivo se investigó acerca de los substratos mas adecuados para la multiplicación masiva de Beauveria brongniartii y el efecto del uso de diferentes estiércoles inoculados con este hongo para el control de N. aberrans. 2. Materiales y métodos Los diversos ensayos se realizaron en laboratorio e invernadero de la Estación Experimental de Toralapa, perteneciente al Programa de Investigación de la Papa (PROINPA), ubicada en el kilómetro 72 entre la ciudad de Cochabamba y Santa Cruz a una altitud de 3 430 msnm. 2.1. Patogenicidad in vitro de Beauveria brongniarti1 sobre Nacobbus aberrans Huevos, segundos, terceros y cuartos (J2,J3 y J4) estados juveniles además de adultos de N. aberrans obtenidos en laboratorio a partir de nódulos radiculares, fueron colocados en cajas petri con Agar-Agua al 2%, en un número de 40 individuos por caja petri por estadío, excepto adultos que solamente se colocaron 20. Conidias de B. brongniartii desarrolladas en medio de cultivo Papa-Dextrosa-Agar (PDA) fueron recolectadas para obtener una suspensión de conidias (13.3 x 106 conidias/cc), que en un medio aséptico y con un atomizador se inocularon a cada caja petri. Estas se incubaron a 24oC y se efectuaron seis observaciones (3, 6, 16 horas; 3, 6 y 9 días después de la inoculación) tomando cuatro individuos por estadio, los cuales fueron montados en azul de lacto fenol y observados al microscopio. Paralelamente se efectuó una PRUEBA DE EFICIENCIA DE PARASITISMO, para lo cual se colocaron en pequeñas cajas petri 50 individuos de diferentes estadios de N. aberrans en una suspensión de conidias (13.3 x 106 conidias/cc). Luego de ser incubados a 24oC por 20 días, se efectuaron observaciones al estereoscopio y microscopio, para ver el efecto del hongo. Para confirmar el parasitismo, aquellos estados con presencia del hongo fueron sembrados en PDA e incubados a 24oC. Después de siete días se observó bajo estereoscopio y microscopio el desarrollo de las colonias para identificar al hongo. 2.2. Substratos para multiplicación e incorporación de B. brongniartii 2.2.1. Substratos básicos para multiplicación Se evaluaron diferentes metodologías para seleccionar substratos básicos (arroz, cebada flotante, borra de cerveza, rastrojo de cebada) para la multiplicación del hongo. 2.2. 2. Substratos para incorporación a campo (estiércoles) Se utilizó estiércol vacuno, ovino (recolectados de corrales, los cuales estuvieron expuestos a la intemperie por varios meses) y gallinaza (recolectada de galpones de producción de pollos parrillero con cama de cascarilla de arroz). Se utilizaron 147 g de cada estiércol añadiendo 100 cc de agua al estiércol de vacuno, 150 cc al de ovino y 100 cc a la gallinaza. La cebada flotante recibió un erre tratamiento (cocción). La prueba se realizó en un diseño completamente al azar con arreglo factorial de 4 x 3 con 6 repeticiones, donde los factores fueron: 1o SUBSTRATO: E. vacuno (EV), E. ovino (EO), gallinaza (G) y Cebada flotante (CF), 2o INOCULO: CF infectada en tres porcentajes del substrato (5, 10 y 20%) lo que correspondió aproximadamente a 7.5; 15.0 y 30.0 g de inóculo. Luego de la inoculación, cada bolsa fue incubada por 20 días a 24oC. Para la evaluación, cada bolsa (tratamiento) se agitó suavemente, extrayendo aproximadamente 9 cc de su contenido. Los grumos (agregaciones naturales de cada estiércol) fueron esparcidos por toda la superficie de una caja petri y observados al estereoscopio donde se contó cada grumo en el que existía el hongo como una unidad. Sumando todos los campos de la caja se totalizó el efecto del inóculo en cada tratamiento. 2.3. De patogenecidad in vivo de B. brongniartii Para este ensayo (invernadero) se utilizó suelo naturalmente infestado con N. aberrans, el cual fue previamente (5 meses antes) sembrando con semillas de Spergula arvensis (maleza) para aumentar y homogenizar el inóculo del suelo. La determinación de la población inicial (Pi) de N. aberrans se efectuó por un bioensayo con seis repeticiones, estandarizando la presencia de los nematodos en raíz y suelo a 100 g de suelo. El ensayo se efectuó en un diseño completamente al azar con arreglo factorial de 4 mezclas de substratos (E. vacuno, E. ovino, gallinaza y Suelo), 2 inóculos. (estiércoles y suelo con y sin B. brongniartii) y dos fechas de aplicación (antes y a la siembra) con 6 repeticiones. Se utilizaron 147 g de substrato por planta (aproximadamente equivalente a una dosis de 7 tn/ha), para los diferentes estiércoles con y sin inoculación de B. brongniartii. La inoculación con el hongo a los estiércoles se efectuó con CF infectada en una dosis de 10 g/147 g de estiércol lo que corresponde a 6.8%. En el caso del suelo, este corresponde al testigo siendo uno para los substratos con hongo y el otro (sin hongo) como testigo absoluto. Los estiércoles inoculados se incubaron por 15 días a 24 oC para luego ser incorporados al suelo. El tratamiento de aplicación antes, fue de 15 días, para E. vacuno, E. ovino y la CF infectada (10 g directamente al suelo). En el caso de la gallinaza se efectuó 30 días antes.(en base a pruebas adicionales, para que no dañe los brotes de la semilla). La aplicación a la siembra fue igual para todos los tratamientos. Se utilizaron 1200 g de suelo infestado con N. aberrans por maceta. Para la siembra se utilizaron tubérculos semilla de la variedad Waych'a (susceptible a N. aberrans). Durante el desarrollo de las plantas se efectuaron los riegos y cuidados necesarios. El efecto del parasitismo de B. brongniartii sobre N. aberrans se estableció de dos formas: 2.3.1. Efecto sobre la relación nemátodo planta La EVALUACIÓN de los tratamientos se efectuó 95 días después de la siembra por el número de nódulos en le raíz; número y peso de tuberculillos; peso de la raíz; peso de follaje fresco y seco. Además también se tomó como un parámetro el número de nódulos por gramo de raíz.. En laboratorio se determinó la población final (Pf) de N. aberrans en muestras de raíces y de suelo por los métodos de la licuadora y/o centrifugadora, respectivamente. El número de nemátodos saprófitos en el suelo fue también determinado. 2.3.2. Parasitismo in vitro El efecto del posible parasitismo ocurrido en la anterior prueba se estimó por el porcentaje de eclosión de los segundos estados juveniles de 10 nódulos que luego de pesados se procesaron por el método de la licuadora y en una alícuota de 4 cc del total (100 cc) se contó el número de huevos existentes. Luego, estos huevos fueron incubados por 15 días a 24oC para evaluar su viabilidad, contando el número de segundos estados juveniles que lograron eclosionar, y dicho número fue llevado a porcentaje. 3. Resultados y discusiones 3.1. Patogenicidad in vitro de B. brongniartii sobre N. aberrans En los diferentes estadíos asperjados con las conidias del hongo (13.3 x 106 conidias/cc) se observó que estas se adhirieron a la superficie de todos los estados (huevo, J2, J3, J4 y adultos) para luego germinar y parasitar cada individuo. Sin embargo los nemátodos en fase de muda no fueron atacados por el hongo. En la prueba de eficiencia se encontró un 64 % de parasitismo en juveniles de N. aberrans. Resultado similar (50 % de parasitismo) se obtuvo al utilizar B. bassiana como una alternativa para el control de Globodera pallida (Franco et al., 1989). 3.2. Substratos para multiplicación e incorporación de B. brongniartii 3.2.1. Substratos básicos para multiplicación De los substratos utilizados (arroz, cebada flotante, borra de cerveza y rastrojo de cebada) para la multiplicación de B. brongniartii el arroz fue el más eficiente cuando se esterilizó (autoclave) por 35 minutos en una relación de 500 g del grano más 200 cc de agua en bolsas de celofán cerradas y se inoculó ya sea con el hongo desarrollado en medio de cultivo Papa-Dextrosa-Agar ó arroz infectado. En segundo lugar se encontró a la cebada flotante (deshecho de la fabricación de la cerveza), previo tratamiento de cocción, donde el hongo se propagó solamente cuando el material de inoculación fue el hongo desarrollado en PDA. El tiempo de desarrollo del hongo en arroz es menor cuanto mayor es el porcentaje de arroz infectado utilizado como inóculo. Sin embargo en la cebada flotante no existió desarrollo del hongo cuando se utilizó el mismo tipo de inóculo (arroz infectado). 3.2.2. Substratos para incorporación a campo (Estiércoles) Se determinó que los volúmenes de agua a incorporarse t a cada estiércol (147 g) para obtener la humedad necesaria fueron de 100 cc para los estiércoles de vacuno y gallinaza y de 150 cc para el estiércol de ovino. Resultado de los análisis estadísticos y comparaciones efectuadas para evaluar el establecimiento del hongo en cada estiércol mostraron que los factores estiércol, inóculo y la interacción de ambos fueron significativos. Sin embargo del análisis de la interacción simple se determinó que en la cebada flotante (cuando es inoculada con el hongo desarrollado en cebada flotante) no existió ningún tipo de desarrollo. Por el contrario en los estiércoles de ovino y vacuno el establecimiento del hongo fue significativamente más eficiente a medida que se aumentó el inóculo (5, 10 y 20 %). Al efectuarse una discriminación de medias (SNK 1%) sobre el efecto de los estiércoles se determinó un mejor establecimiento del hongo en el estiércol de ovino, seguido del vacuno. En la gallinaza solamente pudo apreciarse la presencia del inóculo original y no así un establecimiento real. 3.3. Patogenicidad in vivo de B. brongniartii 3.3.1. Efecto sobre la relación nemátodo planta La población inicial (Pi) de N. aberrans que se utilizó en esta prueba fue de 218.33 nemátodos/100 g de suelo y constituyó la base para evaluar el efecto de los substratos en sus diversas combinaciones sobre el desarrollo de las plantas y de N. aberrans. 3.3.1.1 Desarrollo de la planta y su producción Análisis de varianza de los datos transformados (√x + 0.5)de las variables de peso radicular, follaje y tubérculos mostraron un coeficiente de variación que no superó el 20% y que los factores época (B), estiércol (C) y la interacción época x estiércol (B x C) fueron altamente significativos. Resultados del análisis de las interacciones en cada una de las variables se encuentran resumidos en la tabla 3.1. Los pesos de raíces, follaje y tubérculos mostraron alta significancia estadística cuando se aplicó la gallinaza antes de la siembra (45.31, 5.66 y 40.12 g respectivamente), con respecto a los obtenidos cuando esta se aplicó a la siembra (1.98, 0.36 y 0.36 g respectivamente). Este efecto se debió básicamente a la fuerte fermentación de la gallinaza que produjo efectos fitotóxicos sobre los brotes del tubérculo-semilla. El estiércol vacuno también mostró alta significancia estadística en el peso de tubérculos obteniéndose mayores pesos de los tubérculos cuando este estiércol se aplicó antes de la siembra (36.98 y 24.26 g). Estos efectos pueden verse más objetivamente en la figura 3.1. Tabla 3.1. Efecto de la interacción épocas (antes de la siembra y en la siembra) x Estiércoles sobre la variable de peso radicular, follaje y tubérculos (datos originales)
NS = No significativa estadísticamente ** = Altamente significativo (1 % de probabilidad) El análisis de el efecto principal de los estiércoles se puede apreciar en la tabla 3.2, donde se observa que el estiércol vacuno mostró mayores pesos radiculares seguido del ovino, la gallinaza y la cebada flotante. En el peso de follaje y de tubérculos los estiércoles vacuno y ovino no mostraron diferencia significativa, pero fueron mayores que los de la gallinaza y la cebada flotante. Sin embargo, nuevamente la gallinaza mostró menores valores cuando se aplicó a la siembra (efectos fitotóxicos sobre los brotes) que cuando se aplicó antes de la siembra (figura 3.1.) donde alcanzó los mayores valores en los tres parámetros. Tabla 3.2. Efecto de los estiércoles sobre las variables de peso radicular, follaje y tubérculos (datos originales).
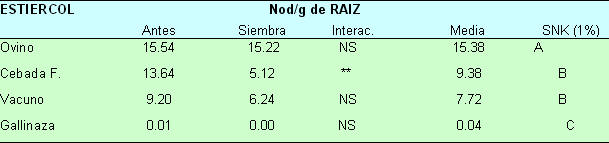
3.1.2. Parasitismo de Nacobbus aberrans Los datos de la TASA DE MULTIPLICACION y el NUMERO DE NODULOS POR GRAMO DE RAIZ fueron transformados (log (x + 10)) para los respectivos análisis de varianza, donde los coeficientes de variación no fueron mayores a 14 %. Los NODULOS POR GRAMO DE RAIZ mostraron alta significancia en los efectos principales de época (B), estiércol (C) y la interacción época x estiércol (B x C). Los análisis de la interacción y el efecto principal de los estiércoles se resumen en la tabla 3.3. Del análisis de la interacción para el número de nódulos por gramo de raíz solamente la cebada flotante mostró alta significancia respecto de la época de aplicación, obteniéndose mayor nodulación cuando se aplicó antes de la siembra (13.64 nod/g) que a la respectiva siembra (5.12 nod/g). Al analizar el efecto principal de los estiércoles en sus promedios (Tabla 3.3.), los mayores valores de infección radicular se encontraron con el estiércol ovino (15.38 nod/g) seguidos de la cebada flotante y estiércol vacuno, ambos sin diferencias estadísticas (9.38 y 7.72 nod/g) y finalmente la gallinaza con apenas 0.035 nod/g. Tabla 3.3. Efecto de los estiércoles y la interacción de épocas x estiércoles sobre el numero de nódulos por gramo de raíz (datos originales)
La TASA DE MULTIPLICACION mostró significancia en la época (B) y alta significancia para los estiércoles (C). Un análisis de medias del efecto de los estiércoles se muestra en la tabla 3.4. Las mayores tasas de multiplicación (TM) se encontraron con los estiércoles vacuno y ovino (ambos estadísticamente iguales), seguidos de la cebada flotante y finalmente la gallinaza con una TM igual a cero. Tabla 3.4. Tasa de multiplicación como respuesta a la aplicación de estiércoles (datos originales).
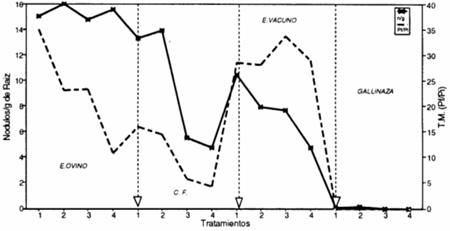
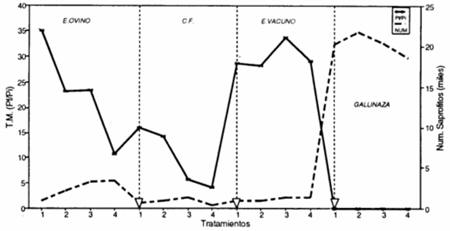
La formación de nódulos por gramo de raíz y la tasa de multiplicación en respuesta a la aplicación de los estiércoles antes y a la siembra presentó un fenómeno muy interesante, lo cual puede verse en la figura 3.2.
Se observa un posible efecto de B. brongniartü como biocontrolador de N. aberrans sobre el número de nódulos por gramo de raíz (trat. 1,2,3 y 4) como respuesta al estiércol ovino, en el que hubo un mejor establecimiento del hongo. En los tratamientos con el hongo (trat. 1 y 3) existe un menor número de nódulos por gramo de raíz (15.09 y 14.82 respectivamente) comparados con sus respectivos testigos sin aplicación del hongo (trat. 2=15.99 y 4=15.61). En la cebada flotante con el hongo aplicado antes de la siembra (trat. 1=13.35) también se observa igual fenómeno comparado con el tratamiento 2 (13.93), que no tiene incorporación de B. brongniartll respectivamente). Este efecto es probable que se deba a que el número de nódulos formados representa a los individuos que ingresaron al sistema radicular y lograron escapar al parasitismo del hongo. En cambio para la tasa de multiplicación se tomó la cantidad total de huevos existentes en la población final, sin considerar la viabilidad de cada uno de estos (habilidad de eclosionar e invadir las raíces de las plantas) donde pudo haber existido un parasitismo directo o indirecto. Por lo tanto, si bien no existe una diferencia estadística por efecto de B. brongniartii esto no quiere decir que el control biológico no ocurrió. Este hecho implica que, posiblemente el efecto del hongo sobre el nematodo deba medirse en función a la capacidad de eclosión e infectividad de los juveniles (J2) de N. aberrans, después de terminado el ciclo del cultivo de papa, lo que se evidenciaría en la próxima campaña agrícola. El comportamiento del nematodo fue afectado directa y rápidamente en su tasa de multiplicación y el número de nódulos formados por gramo de raíz, solamente en los tratamientos con gallinaza, por los procesos indicados anteriormente y que podrían ser investigados, para un uso más eficiente de la gallinaza. Por otro lado teniendo en cuenta que el hongo fue propagado en medio artificial aproximadamente por diez meses (hasta el momento de su aplicación en las macetas), es probable que la baja patogenicidad presentada se deba a la pérdida de virulencia de sus conidias. Jayaramaiah y Veeresh (1984) trabajando con la misma especie de hongo, encontraron que en 14 semanas (tres y medio meses) de almacenamiento la viabilidad de las conidias bajó de 82.84 a 6.66 %. Así mismo Kmitowa y Bajan (1982) trabajando con B. bassiana encontraron que existe una marcada influencia de el origen geográfico del strain, la taxonomía del hospedero de donde se aísla y el tiempo de cultivo artificial en la patogenicidad de este hongo. De acuerdo a los resultados obtenidos y por los trabajos de otros autores, es necesario tomar muy en cuenta para trabajos sucesivos el tiempo de almacenamiento en medio artificial. Respecto al origen taxonómico del aislamiento, sería acertado contar con aislamientos del hongo a partir de nematodos infectados provenientes de zonas donde existe Beauveria spp., y para la cual sería necesario el uso de métodos de aislamiento adecuados. El origen geográfico tiene estrecha relación con el anterior punto, por lo tanto los aislamientos deben efectuarse en zonas paperas, ya que según Brady (1979) la especie Beauveria spp. se encuentra distribuida en todo el mundo, por lo tanto, la búsqueda debe efectuarse con diferentes strains capaces de controlar N. aberrans. 3.1.3. Tasa de multiplicación de N .aberrans y nemátodos saprófitos La relación entre la tasa de multiplicación de N. aberrans con el número de nematodos• saprófitos observados en los diversos tratamientos presenta características muy interesantes, que se pueden ver en la figura 3.3.
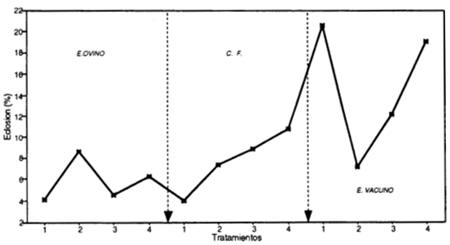
El número de nematodos saprófitos se mantiene bajo en los estiércoles de ovino, vacuno y cebada flotante, pero en el caso de la gallinaza se incrementa a niveles muy elevados (aproximadamente 20 000 saprófitosí100 g de suelo) y la tasa de multiplicación de N. aberrans baja a cero. El efecto nematicida de la gallinaza parece afectar solamente a nematodos fitoparásitos, como N. abarrans, más no así a los saprófitos que una vez desaparecido el efecto de la gallinaza, tienen la capacidad de recuperarse rápidamente y colonizar los suelos tratados. Por lo observado con este abono orgánico, su aplicación ha mostrado las siguientes ventajas: gran calidad nutritiva (figura 3.1.), fuerte efecto nematicida (figura 3.2.) y gran calidad como materia orgánica para incrementar el desarrollo de la vida microbiana (figura 3.3.) 3.2. Parasitismo in vitro Para determinar el parasitismo de B. brongnlartil, se evaluó la capacidad de eclosión de huevos provenientes de nódulos formados en los tratamientos de cebada flotante y los estiércoles ovino y vacuno que contenían hembras con masas de huevos. No se incluyó la gallinaza, ya que no se formaron nódulos. Los porcentajes de eclosión de cada uno de los tratamientos indicados se observan en la figura 3.4.
Con el estiércol ovino se puede apreciar que aquellos que fueron inoculados con el hongo B. brongiartii antes ó a la siembra (trat. 1 y 3) presentan un porcentaje de eclosión menor (4.08 y 4.56 % respectivamente) a sus respectivos testigos (trat. 2 y 4) con porcentajes de 8.56 y 6.22% respectivamente. Fenómeno similar se observó en la cebada flotante. En el estiércol vacuno el efecto de el hongo no es el mismo que en los anteriores. De estos resultados y teniendo en cuenta que en el estiércol ovino (Pruebas de substratos de incorporación) existió un mejor establecimiento del hongo y en los tratamientos con cebada flotante solamente se añadieron 10 g de este substrato colonizado por el hongo, se puede sugerir que esta pérdida de viabilidad de los huevos formados se debió al efecto biocontrolador del hongo, ya que este porcentaje de eclosión fue mayor en los tratamientos con la aplicación de estiércol ovino sin el hongo (trat. 2 y 4). Al respecto Rodríguez-Kabana (1991) indica que la descomposición de la materia orgánica da lugar a un crecimiento exponencial de microorganismos del suelo, aduciendo que el principal factor es la materia orgánica añadida. Con respecto a la ocurrencia de un parasitismo eficiente por hongos Gaugler et al, (1989) mencionan que se requieren tres fases que son indispensables luego de inoculaciones con hongos al suelo: persistencia, contacto con el hospedante y germinación de la conidia. En el presente ensayo la persistencia se confirmó al observarse la presencia de B. brongniartii en la evaluación final de el estiércol ovino y de la cebada flotante; pero sin embargo se ignora cuánto tiempo le llevó al hongo establecerse. Es probable que este tiempo fue prolongado, lo que impidió un ataque inicial a los estados vermiformes de N .aberrans y por lo tanto las fases de contacto con el nemátodo y germinación de la conidia no fueron posibles. Sin embargo es probable que el hongo B. brongniartii establecido en el estiércol ovino afectó el porcentaje de eclosión de los huevos al tener el tiempo suficiente para colonizar las masas de huevos producidas por las hembras que se encontraban en los nódulos. Por lo tanto el efecto biocontrolador de este hongo sobre N. aberrans podría observarse en la próxima campaña agrícola y en las sucesivas generaciones del nemátodo, al cumplirse las fases mencionadas. Finalmente se tiene que la materia orgánica en el suelo es de gran importancia ya que incrementa la microfauna del suelo, donde puede llegarse a un equilibrio entre plagas y enfermedades con respecto a sus enemigos naturales. Sin embargo adiciones mayores a 10 tn/ha en las zonas tradicionales de producción de papa son poco factibles por su disponibilidad y el elevado costo que implicaría su uso e implementación. 4. Conclusiones 1. Beauveria brongniartü en pruebas In Vitro es capaz de parasitar al nemátodo del "rosario" de la papa Nacobbus aberrans (Thorne, 1935), Thorne y Allen 1944, en todos sus estados. Sin embargo individuos que se encuentran en fase de MUDA no son atacados por el hongo. 2. El uso de cebada flotante como substrato básico es eficiente para la multiplicación masiva del hongo Beauveria brongniartii, siempre y cuando se inocule con el hongo desarrollado en el medio de cultivo Papa-Dextrosa-Agar (PDA). 3. Beauveria brongniartü desarrollada en substrato de cebada flotante es capaz de establecerse sobre estiércoles de ovino y vacuno usando 6.8 % (aproximadamente 7%) de cebada flotante como inóculo. Sin embargo el estiércol de ovino es el más eficiente, seguido por el vacuno (ambos recolectados de corrales de agricultores). El estiércol de pollos parrilleros (gallinaza) proveniente de industrias avícolas no ofrece condiciones favorables para el establecimiento del hongo por la fuerte fermentación que se produce durante su descomposición en el proceso de incubación. 4. Beauveria brongniartii (mantenido por 10 meses en medio artificial) establecido en estiércol de ovino y vacuno al ser aplicados antes y a la siembra (Invernadero) no disminuyen significativamente la población de Nacobbus aberrans en el cultivo de papa. 5. El estiércol de pollos parrilleros (gallinaza) aplicado en dosis de 147 g/planta (7 tn/ha) disminuye la tasa de multiplicación a cero (Invernadero), ya sea cuando se aplica antes ó a la siembra, lo cual posiblemente se deba a la fuerte fermentación del estiércol, que le confiere propiedades nematicidas. 6. La aplicación de gallinaza no descompuesta (húmeda e incubada) a la siembra tiene efectos fitotóxicos en la brotación de los tubérculo-semilla, causando en algunos casos la muerte de los mismos. 7. La aplicación de gallinaza no descompuesta (húmeda e incubada) cuando es aplicada antes de la siembra (30 días) influye positivamente en la planta de papa, obteniéndose mayor desarrollo radicular, follaje y producción de tubérculos, comparados con los estiércoles de vacuno y ovino. 8. El efecto del estiércol de ovino y vacuno (7 tn/ha) sobre la planta fue similar en relación al desarrollo radicular, peso de follaje y peso de tubérculos. Ambos tuvieron mayor efecto que la cebada flotante y los testigos absolutos. 5. Bibliografía BRADY, B.L.K. 1979.. Descriptions of Pathogenic Fungi and Bacteria; Beauveria brongniartü. England, Commonwealth Mycological Institute. No. 603. 2p. CANTO, S. M. 1987. Los nemátodos y la producción de papa. p. 193-212. En. El cultivo de papa con énfasis en producción de semilla. Lima, Per., Programa de Investigaciones y Proyección Social en Papa-Universidad Nacional Agraria La Molina. CISNEROS, F. H. 1986. Control biológico de las plagas con especial referencia al cultivo de la papa. In. Control integrado de plagas de papa. Ed. por Luis Valencia. Bogota, Col., Centro Internacional de la Papa-Instituto Colombiano Agropecuario. 200p. FRANCO, J.; GONZALES, A.; MATOS, A.; TORRES, H. 1989. Beauveria bassiana Promisor biocontrolador del nematodo quiste de la papa, Globodera pallida. Fitopatología (Lima, Per.) 24(1):24-27. GAUGLER, R.; COSTA, D. E.; LASHOMB, J. 1989. Stability and Efficcacy of Beauveria bassiana Soil Inoculations. Environmental Entomology (USA) 18(3):412-417. HERBAS, R. 1981. Manual de Fitopatología. Ed. Universitaria. Oruro, Bol. 444 p. JAYARAMAIAH, M.; VEERESH, G. K. 1984. Influence of Temperature and Humedity on the Survival of Spores of the Fungus Beauveria brongniartü (Sacc.) Patch. J. Soil Biol. Ecol. 4 (2): 82-85. KMITOWA, K.; BAJAN, C. 1982. Pathogenicity level of various strains of Beauveria bassiana (Bals) Will. Polish Ecological (Pol.) 8(3):409-417. MINISTERIO DE ASUNTOS CAMPESINOS Y AGROPECUARIOS. 1990. Normas de certificación de semilla de papa. Consejo Nacional de Semillas. Bolivia. 11 p. OTAZU, V.; HOOPES, R.; CAERO, G.; HUAYTA, I. 1985. El rosario de la papa causado por Nacobbus aberrans (Thorne, 1935) Thorne y Allen, 1944, su efecto en el rendimiento y algunos aspectos que inciden en su propagación y prevalencia en Bolivia. Fitopatología (Lima, Per.) 20(2):65-70. RODRIGUEZ-KABANA, R. 1991. Control Biológico de Nematodos parásitos de plantas. Nematropica 21(1):111-122. SASSER, J. N. 1987. Interacción de las plagas de las plantas con el ambiente adverso y mejoramiento para la resistencia a las plagas: nematodos. p. 437-453. En Cristiansen y Lewis. Mejoramiento de plantas en ambientes poco favorables. Limusam, Mex. 530 p. TORRES, H. 1991. Incremento masivo de Beauveria para controlar el "gorgojo de los Andes de la papa" y el "gorgojo del camote". Lima, Per. 4 p. (Informe técnico). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||