|
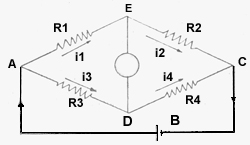
El presente artículo, sin pretensión alguna en el orden científico, busca solamente llenar algún vacío en la comprensión de esta materia, por parte de los alumnos de la Escuela de Agronomía. La idea de escribirlo me la dio el Profesor de Suelos Don Jorge Espinoza. El Puente de Wheatstone en su esquema clásico lo tenemos en la figura (1).
Una pila B conectada a los nudos A y C terminales respectivamente de las resistencias R1, R3 y R2, R4. Los otros dos nudos de esas resistencias E y D están conectados a través de un galvanómetro G.- Este instrumento permite medir una de las cuatro resistencias: R1, R2, R3 o R4, a condición que las otras tres sean conocidas. Para que no pase corriente por el galvanómetro G, es preciso que los nudos E y D se encuentren al mismo potencial.
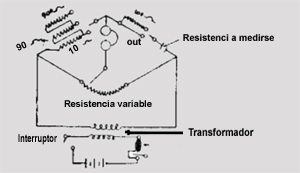
La forma que adopta el Puente de Wheatstone para el objeto que nos preocupa, así nombrado por algunos autores como Puente de Kohlrausch, es la que indica la figura (2).
Vemos que la rama superior izquierda, consta de tres resistencias, que gracias al contacto móvil pueden figurar como de: 10n, 10 + 90 = 100n y 10 + 90 + 900 = 1000n. Las resistencias R3 y R4 quedan reemplazadas por dos segmentos de la resistencia variable, y el punto D del diagrama clásico por el punto de contacto del brazo móvil respectivo con ella. La resistencia a medirse (R2 del circuito anterior), puede ponerse o no en serie con la resistencia fija de 100n, según que el brazo móvil correspondiente se coloque en la posición marcada "IN" o en la posición "OUT". Se reemplaza la corriente constante, por corriente alterna de audiofrecuencia para evitar el efecto de polarización (efecto que prefiero pasar por alto en este artículo), proveniente del secundario de un transformador, cuyo primario se halla en serie con una batería y un vibrador. Empleando corriente alterna, tiene que sustituirse el galvanómetro por unos audífonos. El brazo móvil de la resistencia variable es solidario a un limbo graduado que acusa frente a un índice fijo, por simple lectura, el cociente R4 / R3 de la ecuación (d). Este valor (número) leído, debe multiplicarse por el valor de Rl (que como indicamos anteriormente puede ser de 1On, 100n, o 1000n) para tener el valor de la resistencia medida en ohms. El ajuste del instrumento, previo a l lectura, consiste en girar el brazo móvil de la resistencia, variable (limbo graduado) hasta conseguir que el zumbido en los audífonos acuse la mínima intensidad. En el problema que nos preocupa, la resistencia que medimos, es la de una muestra de tierra saturada de agua destilada, colocada en un, vaso circular de material aislante de dimensiones «estandarizadas, con dos placas metálicas (contactos) diametralmente opuestas, que constituyen los bornes extremos de ella. En el fondo el problema radica en: determinar la concentración de sales solubles en la muestra de tierra, por la medida de su conductibilidad eléctrica, o su inversa, por la medida de su resistencia.
Para explicar el mecanismo de la conducción eléctrica en un electrolito debemos recordar la teoría de Arrhenius, relativa a que sólo una fracción α de las moléculas del cuerpo disuelto está disociada en iones, variando α entre los límites cero y uno. Como sabemos, cada molécula disociada da lugar a dos o más iones que son porciones de molécula que poseen valencias no saturadas y están cargadas de electricidad, denominándose cationes los iones cargados positivamente y aniones los cargados negativamente. También recordemos la posibilidad de considerar la disociación fónica como reacción reversible, susceptible de cumplir la ley de "acción de masas", materias estas que se estudian a fondo en la Escuela de Agronomía. Se denomina "conductibilidad equivalente" el cociente de la conductibilidad específica por la concentración, expresada esta última en equivalentes-gramo de cuerpo disuelto por litro de solución.
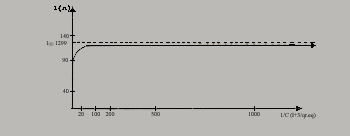
Felizmente se ha constatado que los electrólitos fuertes, como son el NaCl y el Na2SO4 para concentraciones inferiores a 0,01 gramos-equivalentes litros, el grado de disociación ¥ aunque teóricamente es inferior a uno, prácticamente difiere poco y puede considerarse dentro de la exactitud de las mediciones que interesan al agrónomo, igual a uno. Para otro electrolito fuerte como es el KCl, presentó la curva que relaciona diferentes concentraciones con las conductibilidad equivalentes respectivas.
En otras palabras, de la medida de la resistencia calculamos la concentración de la sal disuelta, previa determinación experimental de la constante K del instrumento, la que se realiza, como es lógico, con un electrolito suficientemente diluido pero de concentración conocida.
valiendo la pena anotar que el coeficiente de temperatura indicado: 0,025 es también el coeficiente de temperatura del rozamiento interno del agua. Cochabamba, 21 de Octubre de 1950. |